Tin tức môi trường
Sử dụng Hydrogen sulfide để điều chỉnh cân bằng nội mô trong điều trị các bệnh nhãn khoa
Hydro sunfua (H 2 S) được Carl Wilhelm Scheele xác định thông qua phân tích hóa học vào thế kỷ 17. Tuy nhiên, từ lâu người ta vẫn tin rằng loại khí thải ra từ hệ thống cống thoát nước này có liên quan đến hàng loạt bệnh về mắt đặc biệt xảy ra ở những công nhân thoát nước. Bệnh này có liên quan đến chứng viêm đau, sự xâm nhập thứ cấp của vi khuẩn và thậm chí là mù lòa. Giống như oxit nitric (NO) và carbon monoxide, H2S được tạo ra nội sinh hiện được biết đến như một phân tử tín hiệu khí khác ảnh hưởng đến cấu trúc và chức năng của protein bằng cách tham gia vào các phản ứng cộng hóa trị tồn tại trong thời gian ngắn của chúng. Chất dẫn truyền khí này có thể dễ dàng khuếch tán qua màng tế bào và không cần một cơ chế cụ thể nào cho sự thoái hóa và tái hấp thu của chúng. Ở người, nồng độ H2S trong mô có thể ở mức μM để duy trì các chức năng sinh lý của tế bào. Mức độ của nó có thể khác nhau tùy theo độ tuổi. Ví dụ, nồng độ H2S trong máu ngoại vi thường là 30–300 μM 4 , trong khi nồng độ sinh lý của H2S trong não cao gấp ba lần nồng độ trong huyết thanh. Hệ số phân bố khí/nước H2S là 0,39, hệ số này có thể bị ảnh hưởng bởi pH 2,7. So với người khỏe mạnh, nồng độ H2S trong huyết thanh của bệnh nhân hen suyễn có thể lên tới 600 μM.
Các sản phẩm oxy hóa của H2S bao gồm persulfide, sulfite, thiosulfate và sulfate 9. Khi nồng độ H2S trong mô hoặc tế bào cao, H2S được coi là chất độc hại và các sản phẩm oxy hóa của nó có thể gây ra tác dụng gây độc tế bào thông qua việc ức chế men cytochrome C oxidase của ty thể và làm gián đoạn quá trình sản xuất năng lượng của tế bào, dẫn đến viêm mô hoặc tổn thương DNA. Tuy nhiên, khi nó được tạo ra ở tốc độ sinh lý hoặc ở nồng độ thấp, nó có tác dụng hoàn toàn khác nhau đối với các quá trình sinh học như phân chia tế bào, sửa chữa và chuyển hóa DNA, điều chế protein kinase, điều hòa chu kỳ tế bào và tổ chức khung tế bào. Các nghiên cứu gần đây đã phát hiện ra rằng vai trò điều tiết tiềm năng của H2S là bổ sung cysteine, một nhóm thiol trong protein (còn gọi là S-sulfhydration, hoặc hình thành persulfide). Việc sửa đổi này làm thay đổi nghiêm trọng các hoạt động sinh lý và tình trạng bệnh lý của protein để phản ứng với tình trạng viêm hoặc oxy hóa bằng cách tạo ra nhóm –SSH. Persulfua có khả năng phản ứng tốt hơn thiol tương ứng và có thể dễ dàng phản ứng với các điện di. Quá trình persulfid hóa các protein như K ATP góp phần tạo ra nhiều phản ứng sinh hóa do H 2 S gây ra 13 . Khi H 2 S được sản xuất ở mức độ thấp thông qua quá trình phân hủy enzym của cysor homocysteine, điều này rất quan trọng trong việc duy trì các chức năng của hệ thần kinh và hệ thống mạch máu. Sử dụng H2S từ bên ngoài đã được chứng minh là giúp kéo dài tuổi thọ của giun, giảm viêm và thúc đẩy quá trình phục hồi các mô bị tổn thương. Xét về giá trị tiềm năng của H2S trong hệ thống cơ thể và sự hiện diện của nó trong mắt động vật có vú, tổng quan này tập trung vào vai trò của H2S trong các bệnh nhãn khoa thông thường và các cơ chế cơ bản, hy vọng cung cấp chiến lược điều trị cho các bệnh nhãn khoa. Phân tích chi tiết về nhiễu xuyên âm giữa các mô mắt và con đường tạo H2S sẽ mở đường cho sự hiểu biết về cơ chế bệnh sinh của nhiều bệnh nhãn khoa và tối ưu hóa việc ứng dụng chất cho H2S để điều trị.
Trong tế bào động vật có vú, việc tạo ra H2S phụ thuộc vào bốn enzyme chính: Cysathionine-γ-synthase (CSE), Cysathionine-β-lyase (CBS), 3-mercapto-methylthio pyruvate aminotransferase (3MST) và cysteine aminotransferase (CAT). Nói chung, việc tạo ra H2S phụ thuộc vào quá trình khử lưu huỳnh của cysteine hoặc homocysteine bằng hai enzyme phụ thuộc pyridoxial 5-phosphate (PLP), CSE và CBS. Điều đáng chú ý là sự phân bố của các enzyme này để sản xuất H2S cho thấy tính đặc hiệu của mô. Ví dụ, CBS là enzyme chính tạo ra H2S trong hệ thần kinh trung ương. CSE là enzyme chính sản xuất H2S trong hệ thống mạch máu, gan và thận. Sự hiện diện của các enzyme sản xuất H2S này được chứng minh trong các mô của mắt, đặc biệt là ở võng mạc. Theo các nghiên cứu gần đây, H2S cũng có thể được sản xuất từ D-cysteine, được xúc tác bởi D-Amino acid oxidase (DAO) và 3MST.
Sản xuất nội sinh H2S được phát hiện trong các mô khác nhau của mắt bò, bao gồm giác mạc, thủy dịch, mống mắt, cơ mi, thấu kính, màng mạch và võng mạc, ngoại trừ thủy tinh thể. Sản lượng H2S nội sinh cao nhất được phát hiện ở giác mạc và võng mạc. CBS được biểu hiện nhiều nhất ở giác mạc, kết mạc và mống mắt, trong khi lượng CBS được tìm thấy thấp hơn nhiều ở võng mạc và thần kinh thị giác, lượng tương đối thấp hơn ở thể thủy tinh, nhưng không có ở thể thủy tinh. Biểu hiện CBS vẫn ở mức cao ở các phân đoạn trước trong suốt cuộc đời và nó có xu hướng tăng ở võng mạc phụ thuộc vào độ tuổi 24. CSE được đặc trưng ở võng mạc của động vật lưỡng cư và động vật có vú, nơi hoạt động của nó có thể được theo dõi. Con đường 3MST/CAT là cách chủ yếu để tạo ra H2S ở võng mạc động vật có vú vì cả 3MST và CAT đều nằm trong tế bào thần kinh võng mạc, được tăng lên ở nồng độ Ca 2+ thấp đạt được độ sáng. Sự thiếu hụt H2S hoặc các chất nền của nó được phát hiện có liên quan đến bệnh ngoài tử cung, cận thị, đục thủy tinh thể, teo thị giác và bong võng mạc.
Thế hệ H2S chủ yếu được kiểm soát bởi bốn enzyme, CBS (nguồn sản xuất H2S chính trong hệ thần kinh trung ương), CSE (nguồn sản xuất H2S chính trong hệ thống mạch máu, gan và thận), 3MST và CAT (nguồn chính sản xuất H2S ở võng mạc). CSE và CAT được điều hòa bởi Ca 2+. H2S được tạo ra bởi các enzyme này ở nồng độ Ca 2+ nội bào ở trạng thái ổn định thấp. Nhiều mô mắt cho thấy sự hiện diện của H2S nội sinh, bao gồm thủy tinh thể, mống mắt, màng đệm, cơ thể mi, thủy dịch, giác mạc và võng mạc, ngoại trừ thủy tinh thể. Nồng độ H2S nội sinh cao nhất được phát hiện ở giác mạc và võng mạc, trong đó việc sản xuất các enzyme chính của chúng khác nhau
H2S và bệnh tăng nhãn áp
Giảm áp lực nội nhãn (IOP)
IOP cao là nguyên nhân chính gây ra bệnh thần kinh thị giác ở bệnh nhân tăng nhãn áp, làm tổn thương các tế bào thần kinh võng mạc và đầu dây thần kinh thị giác. IOP ổn định phụ thuộc vào sự cân bằng của việc tạo ra thủy dịch (AH) trong thể mi và dòng AH thoát ra ở góc buồng, đặc biệt là trong lưới phân tử. Cơ sở dòng chảy có thể được tăng lên bằng cách sử dụng adenosine monophosphate (cAMP) tuần hoàn trong khoang trước để duy trì IOP. Các hợp chất giải phóng H2S có thể hoạt động trên các kênh adenylyl cyclase và kênh kali nhạy cảm ATP (K ATP ) trong mắt, do đó làm tăng nồng độ cAMP trong các phần trước mắt của lợn và giúp điều hòa dòng chảy ra của AH. Nghiên cứu ex vivo đã chỉ ra rằng H2S tham gia vào quá trình ức chế phosphodiesterase (PDE) và tăng cường nồng độ cAMP nội ty thể, kích thích protein kinase A (PKA) để tạo ra các hiệu ứng năng lượng sinh học. Sự ức chế hoạt động PDE của H2S là yếu tố liên quan đến sự tích lũy cAMP và guanosine monophosphate tuần hoàn (cGMP). Trong khi đó, mức cGMP nội nhãn tăng cao có liên quan đến việc giảm thể tích tế bào lưới phân tử và thúc đẩy dòng chảy ra ngoài của AH 37 . Các nhà tài trợ sản xuất H 2 S như GYY4137, được nghiên cứu kỹ lưỡng để ổn định IOP, vì chính quyền của họ điều chỉnh tăng biểu hiện glutathione nội nhãn (GSH) với mức cGMP tăng.
Các nhà tài trợ H2S cũng hoạt động trên màng bồ đào trước để thư giãn cơ trơn mống mắt và do đó làm giảm IOP. Mặt khác, norepinephrine được giải phóng bởi các đầu dây thần kinh giao cảm bị thoái hóa nội nhãn có thể làm giảm khả năng thoát ra với IOP tăng cao sau đó trong thời gian dài, mặc dù nó có thể dẫn đến sự gia tăng cấp tính của khả năng thoát ra41 . Nồng độ norepinephrine trong AH tăng vào ban đêm có liên quan đến sự gia tăng chứ không phải giảm IOP ở thỏ. H2S có thể làm giảm sự giải phóng norepinephrine từ dây thần kinh giao cảm, góp phần ổn định IOP.
Tác dụng lên việc cung cấp máu cho mắt
Thiếu máu cục bộ có thể gây tổn thương bệnh tăng nhãn áp kèm theo hoặc không kèm theo IOP bất thường. Các nghiên cứu in vivo đã tiết lộ rằng việc cung cấp máu không đủ có thể dẫn đến teo đầu dây thần kinh thị giác và chết tế bào ở hạch, điều này ngụ ý rằng lưu lượng máu mắt bất thường (OBF) nhất thiết ảnh hưởng đến quá trình trao đổi chất để thích ứng với nhu cầu chức năng thị giác .
Một số báo cáo mâu thuẫn được công bố về phản ứng dược lý của H2S trong mạch máu của các cơ quan khác nhau ở các loài khác nhau. Người ta báo cáo rằng nồng độ cao của GYY4137 (1 mM) có thể làm tăng đáng kể trương lực do phenylephrine gây ra trong động mạch mắt của thỏ, nhưng nhiều bằng chứng hơn đã chứng minh rằng người hiến H2S mới có tác dụng giãn mạch trên các động mạch mi sau đã co trước (PCA), rất quan trọng đối với OBF. Nồng độ thấp của GYY4137 (100 nM–100 μM) có thể tạo ra sự thư giãn trong PCA khi có sự hiện diện của trương lực do phenylephrine gây ra thông qua sản xuất nội sinh của cả hai tuyến tiền liệt và H2S. AP72 và AP67 cho thấy tác dụng giãn mạch đối với PCA do phenylephrine gây ra theo cách phụ thuộc vào nồng độ. Những tác động này chủ yếu phụ thuộc vào hoạt động trên các kênh K ATP của H2S. Kết hợp lại với nhau, những nghiên cứu này đã xác định vai trò của H2S trong việc điều chỉnh OBF của bệnh tăng nhãn áp.
Bảo vệ tế bào thần kinh
Các đặc điểm chính của bệnh tăng nhãn áp bao gồm sự chết tế bào tiến triển của hạch võng mạc và tổn thương thần kinh thị giác, thường gây ra do mất các yếu tố dinh dưỡng thần kinh, độc tính nội bào và ngoại bào của glutamate và viêm thần kinh. Trong hệ thần kinh, H2S hoạt động như chất dẫn truyền thần kinh và có khả năng ức chế quá trình chết theo chương trình và sự thoái hóa của tế bào thần kinh. H2S do tế bào hình sao tạo ra hoạt động như một bộ điều biến khớp thần kinh và gây ra sự kích thích cho các tế bào thần kinh gần đó bằng cách kiểm soát dòng ion canxi của tế bào hình sao. Đối với mắt, các thí nghiệm in vitro đã chứng minh rằng việc bổ sung các chất cho H2S vào hệ thống nuôi cấy sẽ ức chế hiệu quả sự giải phóng dẫn truyền thần kinh giao cảm từ thể mi-mống mắt của bò bị cô lập56 và ức chế dẫn truyền thần kinh axit amin ở võng mạc của bò bị cô lập, được trung gian bởi hoạt động của nó trên các kênh K ATP hoặc NO synthase.
H2S không chỉ có thể tăng cường các phản ứng qua trung gian thụ thể N-methyl-D-aspartate (NMDA) ở nồng độ sinh lý20 mà còn điều chỉnh các thụ thể NMDA được kích hoạt quá mức thông qua trục cAMP. Sự chuyển hóa hoặc đường truyền tín hiệu bất thường của H2S được tìm thấy trong nhiều bệnh thoái hóa thần kinh khác nhau, chẳng hạn như nồng độ H2S giảm ở bệnh nhân Alzheimer, sự phiên mã CSE bị suy giảm ở bệnh Huntington, tình trạng mất nước trong bệnh Parkinson và nồng độ H2S tăng lên. được tìm thấy trong bệnh xơ cứng teo cơ một bên. Thực tế là H2S điều chỉnh các chức năng của tế bào, bảo vệ tế bào thần kinh khỏi bị apoptosis hoặc stress oxy hóa đã được xác nhận rộng rãi. H2S có thể trung hòa lượng peroxynitrite dư thừa (ONOO − ) hoặc các gốc tự do khác, đối kháng với quá trình peroxy hóa lipid và oxy hóa thiol, đồng thời đảo ngược rối loạn chức năng ty thể. Nó hoạt động như một chất chống oxy hóa để loại bỏ lượng glutamate dư thừa cùng với glutathione, cũng như kích hoạt các kênh K ATP để chống lại độc tính của glutamate oxy hóa. H2S có thể ức chế sự tạo ra các loại oxy phản ứng (ROS) và cải thiện tác dụng độc hại của axit hypochlorous (HOCl) được tạo ra từ xúc tác myeloperioxidase (MPO), do đó phát huy tác dụng chống oxy hóa và bảo vệ tế bào thần kinh khỏi tổn thương do clo hóa tế bào. H2S thể hiện tác dụng chống apoptotic trên dòng tế bào SH-SY5Y ở nồng độ thấp bằng cách duy trì các chức năng của ty thể, được gọi là ức chế cytochrom oxydase C và mở các kênh K ATP của ty thể.
Đề cập đến hoạt động chống oxy hóa của các chất cho H2S tác động lên tế bào thần kinh, các nghiên cứu đã phát hiện ra rằng H2S có thể làm tăng nồng độ GSH trong tế bào thần kinh bằng cách tăng cường chất vận chuyển cysteine, chất chống phản ứng cysteine/glutamate và γ-glutamyl cysteine synthetase (γ- GCS). γ-GCS và GSH synthetase hoạt động phối hợp trong quá trình tổng hợp GSH. Cả hai enzyme đều có thể được điều chỉnh bởi Nrf2, đây cũng là một mục tiêu tiềm năng của H2S. Hậu quả của con đường Nrf2 do H 2 S điều chỉnh trong tế bào thần kinh là tăng cường sự biểu hiện của glutathione-S-transferase (GST) và heme oxyase (HO-1), các enzyme chống oxy hóa liên quan đến stress oxy hóa. ACS14 và ACS1, hai nguồn cung cấp H2S, được xác nhận là cải thiện mức GSH nội bào và phát huy tác dụng bảo vệ thần kinh thông qua việc mở kênh K ATP77 .
H2S có thể thúc đẩy sự sống của tế bào thông qua kích hoạt hiệu quả protein kinase C-α (PKC-α), ức chế đường truyền tín hiệu NF-κΒ, cũng như điều chỉnh tăng mức độ ức chế apoptosis liên kết với nhiễm sắc thể Bcl-2 và X (XIAP) trong các tế bào RGC được xử lý trước bằng glutamate (Glu) và buthionine sulfoximine (BSO). So với các tế bào RGC được xử lý bằng glutamate, việc bổ sung H2S giúp tăng cường quá trình phosphoryl hóa Akt và thúc đẩy khả năng tồn tại của tế bào để đáp ứng với stress oxy hóa. Trong mô hình chuột bị tăng huyết áp mắt mãn tính, H2S được chứng minh là làm giảm quá trình apoptosis của RGC thông qua việc cân bằng chức năng của ty thể, ngăn chặn sự kích hoạt thần kinh đệm và điều hòa quá trình tự thực. Việc tiêm NaHS vào bên trong khoang cho chuột mắc bệnh tăng nhãn áp sẽ ngăn chặn sự mất mát RGC thông qua việc phục hồi nồng độ H2S ở võng mạc. Việc giải phóng H2S từ GYY4137 trong thời gian dài kết hợp với hệ thống dựa trên PLGA tạo gel tại chỗ, tồn tại đến 72 giờ, đã chỉ ra một ứng dụng tiềm năng lớn trong điều trị bệnh tăng nhãn áp.
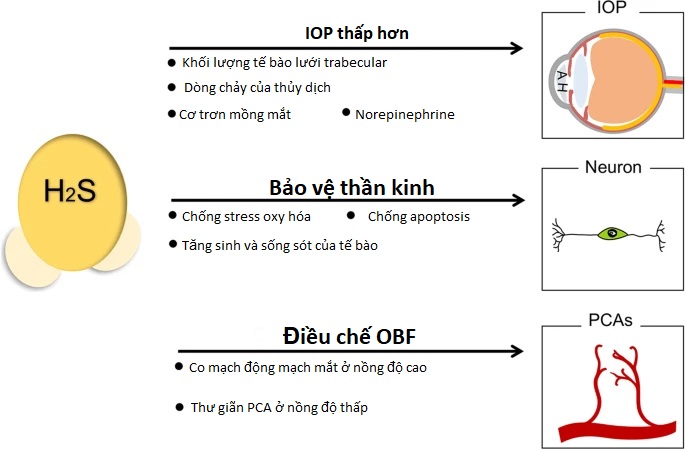
Người cho H2S hạ thấp IOP bằng cách giảm thể tích tế bào lưới phân tử, thúc đẩy dòng AH thoát ra, thư giãn cơ trơn mống mắt và giảm giải phóng norepinephrine. H2S có thể thư giãn PCA để điều chỉnh OBF, nhờ đó làm giảm tổn thương bệnh tăng nhãn áp do thiếu máu cục bộ. Nó cũng làm giảm tổn thương tế bào gây ra bởi các chất oxy hóa và ức chế quá trình apoptosis của tế bào thần kinh để bảo vệ các RGC
H2S và bệnh võng mạc tiểu đường (DR)
Giảm tác dụng của các sản phẩm cuối glycation tiên tiến (AGEs) trong DR
Tình trạng glucose cao gây ra phản ứng ngưng tụ không enzyme giữa glucose và đầu amino của protein, dẫn đến sự tích tụ đại phân tử AGEs, có liên quan chặt chẽ với sự xuất hiện của DR 81 , 82 . AGE có thể liên kết chéo các protein nội bào để làm rối loạn chức năng của chúng và cản trở quá trình trao đổi chất bình thường như sản xuất ATP. AGE phá hủy hàng rào máu-võng mạc (BRB) bên trong mắt gây ra các phản ứng căng thẳng oxy hóa và viêm sau đó.
H 2 S thúc đẩy quá trình chuyển hóa galactose để giảm sự tạo ra AGEs trong tế bào thần kinh và ngăn chặn tình trạng căng thẳng oxy hóa quá mức85 . Về mặt cơ học, H2S làm giảm sản xuất ROS và peroxid hóa lipid, đồng thời tăng cường biểu hiện superoxide effutase (SOD) và glutathione peroxidase (GPX), hai enzyme chống oxy hóa nội sinh. Ngoài ra, H2S có thể đảo ngược sự gia tăng cao do glucose gây ra trong biểu hiện của aldehyd oxidase 1 (AOX-1) và giảm mức độ glutathione synthetase (GSS), cuối cùng là đối kháng với stress oxy hóa do AGEs gây ra trong tế bào.
Ức chế stress oxy hóa và viêm
Mặc dù độc tính của H2S là nguyên nhân gây ra nhiều bệnh, nhưng H2S lại có tác dụng chống viêm linh hoạt trong cơ thể hoặc trong ống nghiệm.
Nồng độ glucose cao làm xáo trộn quá trình chuyển điện tử của chuỗi hô hấp ty thể của tế bào ở bệnh nhân tiểu đường, do đó gốc tự do oxy O- và superoxide có thể dễ dàng được tạo ra. Quá nhiều O − chuyển đổi NO thành ONOO − , chất này có thể liên kết không thể đảo ngược với cytochrome C và làm suy giảm chức năng của ty thể. Trong mô hình động vật DR, mức độ tăng cường của các loại oxy nội bào và quá trình peroxid hóa lipid quá mức liên quan đến nó có thể bị ức chế bởi H2S. Một đặc tính của H2S trong khả năng chống viêm là loại bỏ các chất oxy hóa gây viêm, chẳng hạn như ONOO − , HOCl, superoxide và hydro peroxide. Ngoài ra, phản ứng tiền viêm có thể được chuyển sang phản ứng chống viêm bởi những người cho H2S, như đã được chứng minh là làm giảm nồng độ TNF-α, IL-8 và IFN-γ, đồng thời tăng mức cyclooxygenase (COX)-2 và eicosanoid. Tương tự, GYY4137 đã được báo cáo là có tác dụng ức chế việc sản xuất các chất trung gian gây viêm do LPS gây ra bởi các đại thực bào và điều chỉnh lại việc giải phóng cytokine chống viêm, IL-10 91 [Nhãn FDA] . Sự điều chỉnh như vậy đối với việc sản xuất cytokine gây viêm có thể là do chức năng ức chế của H2S đối với hoạt hóa NF-κB.
Các mô hình động vật của DR đã chỉ ra rằng tình trạng tăng bạch cầu do tăng đường huyết có liên quan đến quá trình chết theo chương trình của tế bào và tắc mao mạch võng mạc. Hiệu quả giải quyết tình trạng viêm bằng H2S phụ thuộc vào vai trò của nó trong việc làm trung gian quá trình thực bào của đại thực bào và thúc đẩy sự sống sót của bạch cầu hạt thông qua việc ức chế quá trình phosphoryl hóa p38 và phân cắt caspase-3. Nó điều chỉnh giảm sự biểu hiện của MPO trong bạch cầu trung tính, do đó làm giảm bớt một số tác dụng độc hại của chúng. Hơn nữa, sự biểu hiện tăng lên ở võng mạc của phân tử bám dính giữa các tế bào-1 (ICAM-1) và sự bám dính của bạch cầu trong mạch máu được quan sát thấy trong mô hình động vật DR93 , nhưng H2S có thể điều hòa quá mức biểu hiện ICAM-1 trong nội mô mạch máu trong điều kiện glucose cao. Các phân tử bám dính, bao gồm kháng nguyên liên quan đến chức năng tế bào lympho, P-selectin và ICAM-1, không thể thiếu trong việc hướng dẫn các tế bào miễn dịch di chuyển qua các mao mạch bị viêm. Sự phong tỏa H2S synthetase làm mất đi tác dụng giảm viêm, đồng thời làm tăng sự kết dính của bạch cầu với nội mô mạch máu và sự di chuyển của chúng.
Các nghiên cứu về sự điều hòa H2S trên cơ tim ở mô hình chuột mắc bệnh tiểu đường loại 1 đã tiết lộ rằng H2S can thiệp vào hệ thống NOS (iNOS)/NO cảm ứng, ức chế hoạt động iNOS và stress oxy hóa qua trung gian dị hóa của nó. Tuy nhiên, chức năng chống viêm của H2S không phải lúc nào cũng đạt được. Ở liều thấp, chất cho H2S ức chế phản ứng viêm, trong khi chất cho H2S liều cao lại đạt được kết quả gây tranh cãi. Do đó, liều lượng là một công tắc để kiểm soát sự điều hòa hai pha của người cho H2S đối với tình trạng viêm và việc tạo ra H2S có thể tăng lên khi xuất hiện tình trạng viêm. Cơ chế phản hồi của H2S trong việc kiểm soát sự tiến triển của phản ứng viêm ở bệnh DR vẫn chưa rõ ràng.
Tác dụng bảo vệ tế bào thần kinh võng mạc
Trong quá trình bệnh lý của DR, tổn thương tế bào thần kinh thường xảy ra sớm hơn và tích tụ thành các tổn thương mạch máu võng mạc có thể nhìn thấy được. ACS67, một nhà tài trợ H2S, có thể được sử dụng để ngăn ngừa quá trình apoptosis của RGC và bệnh thần kinh đệm phản ứng trong tế bào Muller sau khi tái tưới máu thiếu máu cục bộ hoặc tiếp xúc với stress oxy hóa. Ngoài ra, việc sử dụng H2S của người hiến tặng sẽ phục hồi sự biểu hiện của yếu tố dinh dưỡng thần kinh có nguồn gốc từ não (BDNF) và protein túi khớp thần kinh võng mạc ở chuột mắc bệnh tiểu đường do streptozotocin (STZ), cho thấy rằng H2S có thể ngăn chặn sự thoái hóa tế bào thần kinh của võng mạc ở bệnh nhân tiểu đường. Tác dụng bảo vệ thần kinh của H2S ở võng mạc cũng liên quan đến sự điều hòa của nó đối với hàm lượng GSH nội bào.
Vai trò kép của sự ổn định BRB
Rối loạn chức năng của BRB là nguyên nhân chính gây tổn thương mạch máu võng mạc trong quá trình sinh bệnh DR. Trong quá trình phát triển DR, thiếu máu cục bộ võng mạc và thiếu oxy kích thích sự biểu hiện của yếu tố gây thiếu oxy (HIF-1α) và kích hoạt tín hiệu kích hoạt yếu tố tăng trưởng nội mô mạch máu (VEGF) tiếp theo. Con đường truyền tín hiệu HIF-1α-VEGF-VEGFR2 là nguyên nhân gây ra rối loạn chức năng BRB do bệnh tiểu đường và tạo mạch quá mức. Các thí nghiệm in vivo đã chỉ ra rằng tính thấm BRB giảm và giảm mao mạch tế bào ở võng mạc của chuột mắc bệnh tiểu đường do STZ gây ra sau khi điều trị bằng H 2 S ngoại sinh đi kèm với việc giảm hàm lượng VEGF trong thủy tinh thể và biểu hiện gen của VEGFR2, HIF-1α. như với sự biểu hiện gia tăng của occludin. Người ta thấy rằng sử dụng H2S ngoại sinh có tác dụng ức chế sự lắng đọng quá mức laminin và collagen IVα3, nhằm duy trì tính toàn vẹn mạch máu ở võng mạc của chuột mắc bệnh tiểu đường. Mặt khác, VEGF trong mô nội nhãn có thể kích thích tế bào nội mô sản sinh và giải phóng H2S . Khi bắt đầu mắc bệnh tiểu đường, H2S đóng vai trò là yếu tố bảo vệ chống lại stress oxy hóa hoặc stress nitro hóa ở võng mạc và thủy tinh thể, và có vẻ như H2S có vai trò bảo vệ BRB trong tình trạng tăng đường huyết. Tuy nhiên , cùng với sự tiến triển của bệnh võng mạc tiểu đường tăng sinh (PDR), H 2 S có thể tăng cường tác dụng của VEGF lên các tế bào nội mô mạch máu, cũng như quá trình tạo mạch. Các nghiên cứu về nồng độ H2S trong thủy tinh thể và huyết tương của bệnh nhân PDR đã cho thấy biểu hiện cao hơn nhiều, cho thấy tác động tiềm ẩn của H2S trong cơ chế bệnh sinh của PDR. Là một trong những nguồn chính tạo ra H2S ở võng mạc, 3-MST trong các tế bào tăng đường huyết không thể chuyển đổi 3-MP thành H2S khi nồng độ glucose ngoại bào tăng cao và do đó mất khả năng kích thích hình thành mạch hoặc tăng sinh tế bào, nhưng tác dụng tạo mạch của H2S ngoại sinh không bị suy giảm do tăng đường huyết. Hơn nữa, các enzyme tạo H2S/H 2 S góp phần tạo ra tân mạch võng mạc trong bệnh võng mạc do thiếu máu cục bộ. Những sự thật này chỉ ra rằng H2S có thể làm tình trạng xuất huyết võng mạc trở nên trầm trọng hơn trong giai đoạn cuối của PDR.
Bên cạnh tình trạng viêm và apoptosis, sự kết dính tiểu cầu cũng liên quan đến rối loạn chức năng nội mô võng mạc do bệnh tiểu đường. Sự kết dính của tiểu cầu với nội mô bị tổn thương của bệnh tiểu đường tham gia vào tình trạng thiếu máu cục bộ và viêm, cả dòng đông máu và tiêu sợi huyết trong thủy tinh thể đều được xác định trong D . Tiểu cầu trong máu có xu hướng bám vào nội mô mạch máu của bệnh DR hơn là các mạch bình thường, điều này có liên quan đến tắc mao mạch võng mạc và tổn thương vi mạch. H2S đóng vai trò tiềm năng trong việc làm giảm kết tập tiểu cầu, kết dính tế bào và đông máu, nó có tác dụng chống huyết khối thông qua điều hòa tăng tổng hợp NO, thủy phân liên kết disulfide và giảm nồng độ canxi trong tiểu cầu.
Điều chỉnh lưu lượng máu võng mạc
Sự thay đổi tuần hoàn võng mạc của bệnh tiểu đường đã được ghi nhận rõ ràng, chuột mắc bệnh tiểu đường cho thấy mật độ các mạch máu sâu chảy giảm. Có thể có cả sự tăng và giảm lưu lượng máu võng mạc ở bệnh nhân tiểu đường so với người khỏe mạnh, trong khi không thấy sự khác biệt đáng kể về OBF giữa bệnh nhân DR không tăng sinh và PDR. Xem xét khả năng thiếu máu cục bộ và thiếu oxy do cung cấp máu bất thường và rối loạn chức năng mạch máu, chúng tôi nhận thấy rằng H2S có nhiều tác động lên mạch máu. Việc sử dụng chất cho H2S có thể bảo vệ mạch máu, điều hòa huyết áp và làm giảm các phản ứng viêm trong hệ thống mạch máu. H2S thể hiện tác dụng kép co mạch và giãn mạch tùy thuộc vào vùng mạch máu, tình trạng nội mô, nồng độ H2S và phương pháp tiền co mạch. Khác với việc tăng sản xuất cAMP do H2S gây ra trong tế bào não, H2S điều chỉnh tiêu cực chức năng β-adrenoceptor thông qua việc ức chế hoạt động adenylyl cyclase trong tế bào cơ tim. Con đường adenyl cyclase/cAMP có liên quan đến sự co mạch do H2S gây ra , nhưng mặt khác, H2S có thể hướng dẫn các tế bào cơ trơn mạch máu chống lại sự co mạch quá mức thông qua ảnh hưởng đến K ATP. Hơn nữa, H2S làm giảm sự co bóp của cơ trơn mạch máu bằng cách giảm nồng độ canxi nội bào thông qua tác động lên thụ thể inositol 1,4,5- triphosphate. Trong khi các tác động khác nhau của nó lên mạch máu vẫn đang được thảo luận, thì mức cGMP tăng do ức chế PDE, con đường NO/cGMP bị ảnh hưởng với enzyme tổng hợp oxit nitric nội mô được kích hoạt (eNOS) và các sản phẩm phụ chuyển hóa có nguồn gốc COX đều cần thiết cho H2S- gây giãn mạch. Ngoài ra, sự giãn mạch do H2S gây ra có liên quan đến việc thúc đẩy sản xuất prostaglandin, ức chế men chuyển angiotensin, cũng như điều chỉnh khả năng tồn tại của các chất trao đổi anion để kiểm soát giá trị pH nội bào. Tất cả những phát hiện này ngụ ý rằng H2S góp phần điều chỉnh lưu lượng máu võng mạc và có liên quan đến sinh bệnh học DR. (Hình 3 )
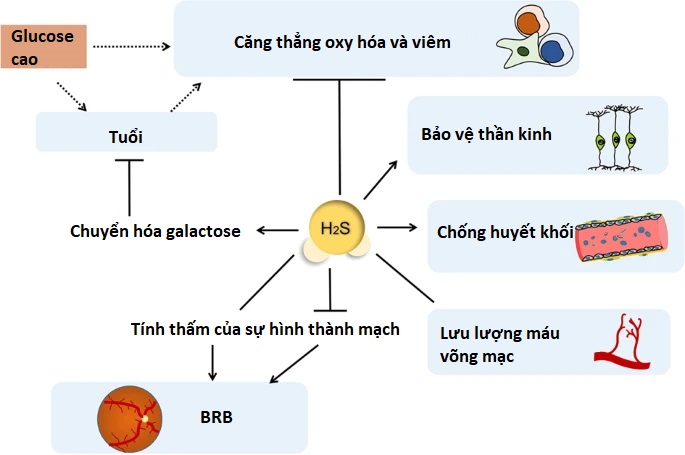
H2S thúc đẩy quá trình chuyển hóa galactose để giảm sự hình thành AGE trong tế bào thần kinh và chống lại stress oxy hóa và viêm nhiễm do glucose cao gây ra, cũng như bảo vệ tế bào thần kinh võng mạc ở bệnh nhân tiểu đường. Mặc dù H2S có thể làm giảm tính thấm BRB của DR và có tác dụng chống huyết khối, nhưng nó cho thấy tác dụng kép lên mạch máu võng mạc để điều chỉnh lưu lượng máu võng mạc và tham gia vào quá trình hình thành mạch.
H2S và thoái hóa võng mạc
Điều chế và bảo vệ tế bào thần kinh võng mạc
Một số bệnh thoái hóa võng mạc, chẳng hạn như viêm võng mạc sắc tố (RP) và thoái hóa điểm vàng liên quan đến tuổi tác (AMD), có liên quan đến chức năng bất thường của biểu mô sắc tố võng mạc (RPE) và tế bào cảm quang, rất quan trọng để duy trì cảm giác thị giác chính xác.
Một trong những đặc điểm của RPE là màng đáy và màng đáy, trong đó các phần đỉnh bao bọc đoạn ngoài tế bào cảm quang (POS) để loại bỏ và phân hủy chúng thông qua quá trình thực bào. Với nhịp sinh học, quá trình thực bào của các đầu xa POS luôn được kích hoạt bởi ánh sáng. Sự xáo trộn chức năng thực bào RPE dẫn đến tích tụ POS và thoái hóa tế bào cảm quang không thể tránh khỏi. Sự thiếu hụt hoạt động của CBS và sự tích tụ homocysteine trong võng mạc có thể dẫn đến cấu trúc và chức năng RPE bất thường, dẫn đến sự phát triển các đặc điểm giống AMD.
Một tính năng khác của tế bào RPE là hình thành hắc tố để hấp thụ ánh sáng dư thừa và bảo vệ các tế bào cảm quang. Sự phân tán melanin về phía vi nhung mao đỉnh của RPE tương quan tích cực với mức cAMP nội bào, trong khi ánh sáng ngăn chặn sự tổng hợp cAMP ở võng mạc của chuột. Người ta đã chứng minh rằng cAMP kích thích tổng hợp melatonin và nâng cao mức cAMP cùng với hệ thống tín hiệu của nó ảnh hưởng đến sự di chuyển RPE. cAMP tăng lên trong không gian dưới võng mạc có thể dẫn đến sự xâm nhập của cAMP vào tế bào RPE thông qua các chất vận chuyển anion hữu cơ dẫn đến kích hoạt các phản ứng sinh lý đặc hiệu trong bóng tối, cAMP không tạo dẫn xuất có thể kích hoạt sự kết tụ hạt sắc tố trong các tấm RPE bị cô lập. Có báo cáo rằng các chất cho H2S và chất nền của nó có thể tạo ra sự gia tăng nồng độ cAMP phụ thuộc vào thời gian và liều lượng trong các tế bào RPE của chuột, quá trình này bao gồm các kênh K ATP và các enzyme của CSE và CBS.
Dòng trao đổi chất của sự truyền tín hiệu tế bào cảm quang được trung gian bởi cGMP được tổng hợp bởi guanylyl cyclase trong tế bào thần kinh võng mạc. Phản ứng được kích hoạt khi các sắc tố quang hấp thụ ánh sáng, sau đó làm giảm cGMP bởi PDE. Các hoạt động thủy phân cAMP và thủy phân cGMP đã được phát hiện trong các chất đồng nhất của biểu mô sắc tố nuôi cấy từ chuột. Có báo cáo cho rằng cGMP kích thích sự hấp thu dịch dưới võng mạc bằng cách kích hoạt bơm tế bào RPE, điều này phù hợp với thực tế là nồng độ cGMP giảm trong các trường hợp bong võng mạc. Như đã đề cập ở trên, H2S tham gia vào quá trình ức chế hoạt động PDE và tạo ra các nucleotide tuần hoàn, và ít nhất ba dạng PDE hiện diện trong tế bào RPE của con người, chúng tôi suy luận rằng cAMP hoặc cGMP tích lũy do H2S hướng dẫn có thể giúp ích. duy trì chức năng sinh lý của RPE và tế bào cảm quang.
Sử dụng H2S góp phần bảo vệ tế bào thần kinh võng mạc khỏi sự thoái hóa do ánh sáng. Các tổn thương mãn tính do ánh sáng gây ra ở vùng điểm vàng gây ra sự thoái hóa của các tế bào RPE và tế bào cảm quang. Tiếp xúc với ánh sáng quá mức trong thời gian dài có thể gây ra tổn thương hoặc chết các tế bào cảm quang do stress oxy hóa và quá tải canxi nội bào . Canxi ở mức tương đối thấp có thể kích hoạt enzyme 3MST/CAT để tạo ra H2S. Ngược lại, H2S có thể ngăn chặn dòng Ca 2+ đi vào tế bào cảm quang bằng cách kích hoạt V-ATPase trong tế bào ngang và duy trì sự cân bằng canxi nội bào, để H2S bảo vệ các tế bào cảm quang khỏi quá trình chết theo chương trình của tế bào võng mạc và stress oxy hóa . Tuy nhiên, sự điều hòa Ca 2+ và tác dụng bảo vệ tế bào của H2S nội sinh có thể thất bại khi các tế bào cảm quang tiếp xúc với ánh sáng quá mức.
Tiềm năng trong liệu pháp ghép tế bào gốc
Các tế bào RPE có thể điều chỉnh sự biệt hóa của tế bào cảm quang và tế bào tiền thân võng mạc, có thể đóng vai trò trong việc điều hòa hốc tế bào gốc võng mạc. Việc cấy ghép RPE có nguồn gốc từ tế bào gốc được chứng minh là có hiệu quả trong việc đẩy lùi tình trạng thoái hóa võng mạc như AMD. MSC là tế bào gốc đa năng với khả năng tự đổi mới, chức năng điều hòa miễn dịch và tiềm năng biệt hóa nhiều dòng. MSC nhân rộng in vitro đã được áp dụng rộng rãi để điều trị nhiều tổn thương mô, chẳng hạn như nhồi máu cơ tim, vết thương ngoài da, ghép tạng, bệnh tự miễn và chấn thương võng mạc. MSC thể hiện CBS và CSE, đồng thời tạo ra H2S, với phản hồi tích cực về sự phát triển và tồn tại của MCS. Các nghiên cứu đã phát hiện ra rằng mức độ H2S nội sinh tăng lên có thể ngăn chặn tình trạng thiếu oxy và quá trình apoptosis do thiếu hụt huyết thanh gây ra bởi MSC, cả con đường truyền tín hiệu ERK và con đường truyền tín hiệu Akt đều tham gia vào việc thúc đẩy H2S trong quá trình tăng sinh tế bào gốc. NaHS có thể kéo dài sự sống sót của tế bào gốc trung mô tủy xương (BMMSC) và tăng cường hiệu quả điều trị của chúng đối với tổn thương do thiếu máu cục bộ, đồng thời có thể cải thiện tính toàn vẹn của mạch máu và thúc đẩy hình thành mạch, với sự điều hòa tăng biểu hiện BDNF và VEGF. Trong quy định về biệt hóa tế bào gốc, H2S có khả năng ảnh hưởng đến sự hình thành tế bào thần kinh bằng cách điều chỉnh trực tiếp các kênh Ca 2+, để khởi động chức năng tế bào tiền thân nội mô và tăng cường quá trình tạo mạch ở các vị trí vết thương ở bệnh nhân tiểu đường tuýp 2.
Ngoài ra, H2S được coi là một trong những phân tử có tiềm năng điều hòa miễn dịch bởi MSC. Sự thiếu hụt H2S làm suy giảm chức năng ức chế miễn dịch của MSC đối với bệnh viêm đại tràng in vivo, trong khi việc bổ sung NaHS có thể khôi phục lại tác dụng điều trị bị suy giảm. Phương pháp điều trị H2S lâm sàng được kỳ vọng sẽ cải thiện khả năng sống sót lâu dài của mảnh ghép cùng loại kết hợp với ức chế miễn dịch vì tác dụng tích cực của nó trong việc thúc đẩy sự sống sót của cơ quan chống lại tổn thương tái tưới máu do thiếu máu cục bộ lạnh. Xét thấy rằng tiền xử lý NaHS có thể tăng cường sự tăng sinh tế bào gốc, thúc đẩy sự sống sót của tế bào gốc và tế bào mô được sử dụng trong điều trị thông qua việc tăng khả năng chống oxy hóa, H2S có thể hữu ích cho việc tái tạo các tế bào cảm quang võng mạc và tế bào RPE thông qua chiến lược cấy ghép.
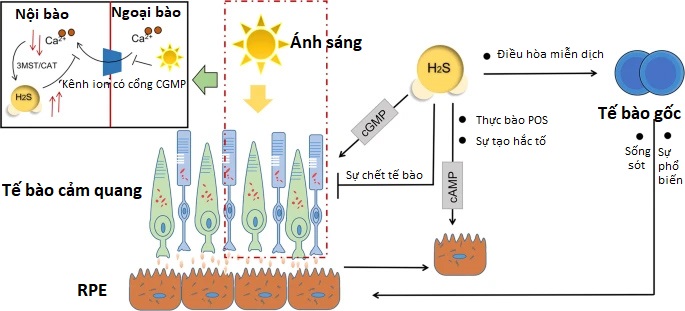
H2S và các enzyme sản xuất của nó tham gia vào quá trình thực bào của POS và hình thành hắc tố trong tế bào RPE, cũng như trong quá trình truyền tín hiệu của tế bào cảm quang. Tiếp xúc với ánh sáng quá mức trong thời gian dài gây ra tổn thương tế bào cảm quang có liên quan đến tình trạng quá tải canxi nội bào. Khi các tế bào cảm quang của võng mạc tiếp xúc với ánh sáng cường độ cao, các kênh ion cGMP trong màng sẽ ngừng hoạt động, với hoạt động theo tầng dẫn đến mức canxi nội bào tương đối thấp. Trạng thái như vậy tạo điều kiện thuận lợi cho việc tạo ra H2S được xúc tác bởi enzyme 3MST/CAT, sau đó ngăn chặn dòng Ca 2+ đi vào bằng cách kích hoạt V-ATPase. H2S ngoại sinh làm giảm số lượng tế bào thần kinh võng mạc bị apoptotic sau khi chiếu xạ ánh sáng quá mức. Một cách tiếp cận khác để điều trị bệnh thoái hóa võng mạc là liệu pháp dựa trên RPE có nguồn gốc từ tế bào gốc. Các nghiên cứu đã phát hiện ra rằng H2S ảnh hưởng đến chức năng điều hòa miễn dịch của MSC và có thể tăng cường sự tăng sinh và khả năng sống sót của tế bào gốc, do đó cải thiện khả năng sửa chữa mô của chúng.